Биология - Метод локальной фиксации потенциала - Решение: patch-clamp, его варианты и конфигурации
09 февраля 2011Оглавление:
1. Метод локальной фиксации потенциала
2. Задача: исследование трансмембранных ионных токов
3. Методики изучения электрических свойств клеточной мембраны
4. Решение: patch-clamp, его варианты и конфигурации
5. Примеры записей, получаемых методом patch-clamp
6. Planar patch-clamp
Гигаомный контакт

В конце семидесятых годов XX в. Эрвин Неер и Берт Сакман обнаружили, что конусообразные стеклянные пипетки с диаметром кончика 1—2 микрона могут образовывать контакты с клеточной мембраной с сопротивлением в несколько гигаом — это так называемый гигаомный контакт. Он позволяет изолировать от внешней среды и от остальной части мембраны тот её фрагмент, который находится внутри пипетки. Отграниченный пипеткой фрагмент мембраны и называется patch — «фрагмент», слово clamp в названии метода можно интерпретировать и как захват и изоляцию этого фрагмента, так и как фиксацию трансмембранного потенциала в изолированном фрагменте, или, как будет описано позже, потенциала или тока на целой клетке. В пипетку, заполненную раствором электролита, помещается хлор-серебряный электрод, второй электрод размещается внеклеточно, в омывающей жидкости. Отличие электрической схемы от ранее описанной для двухэлектродной фиксации заключается в том что один и тот же электрод используется как для измерения разности потенциалов, так и для подачи тока, что оказывается возможным благодаря сраснительно низкому сопротивлению пипетки.
На фото 1 показана часть такой установки.

Огромная сфера, часть которой видна на мониторе в центре фотографии — это клетка, находящийся в данный момент на предметном столике микроскопа, к нему подведена patch-пипетка, её диаметр у носика — около 3 микрон. После установления гигаомного контакта она изолирует фрагмент мембраны площадью приблизительно 7 мкм², ток от ионных каналов в этом фрагменте можно будет записывать.
Конфигурация «Cell-attached»
Только что описанная конфигурация называется cell-attached patch-clamp. Она иллюстрируется схемой 2.
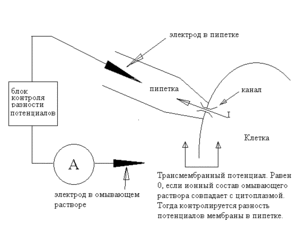
Эта конфигурация, однако, имеет два неудобства.
Во-первых, она не позволяет с достаточной надёжностью измерять, а, следовательно, и задавать трансмембранную разность потенциалов — поскольку оба электрода — как пипеточный, так и внешний, находятся по одну сторону мембраны. Вообще говоря, можно, используя омывающий раствор с ионной композицией, повторяющей состав цитоплазмы, деполяризовать мембрану вне пипетки, так что разность потенциалов между внешним электродом и цитоплазмой исчезнет, а тогда разность потенциалов между электродами окажется равна трансмембранному потенциалу — но все это весьма приблизительно, так как точный состав цитоплазмы нам неизвестен.
Во-вторых, эта конфигурация не позволяет контролировать состав среды вне пипетки — там остаётся цитоплазма, состав которой не вполне определён.
Впрочем, в определенной мере эта особенность конфигурации cell-attached является и достоинством: данная конфигурация позволяет работать в условиях, наиболее близких к физиологическим.
Конфигурация Inside-out
Однако, если пипетку быстрым движением отвести от клетки, то «внутренний» кусочек мембраны оторвется от клетки и получится конфигурация inside-out, названная так потому, что внутренняя, обычно обращенная к цитоплазме, сторона мембраны окажется снаружи — в омывающем растворе, а наружная — внутри пипетки. Альтернативный метод перехода в конфигурацию inside-out заключается в следующем: из конфигурации cell-attached пипетку отводят плавно, формируя с двух сторон закрытую везикулу; затем поднимают пипетку в воздух и опускают во вторую ванночку, с внутриклеточным раствором. При переносе внешняя мембрана везикулы разрушается, в результате формируется конфигурация inside-out.
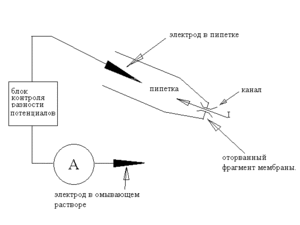
Теперь разность потенциалов на фрагменте мембраны строго равна разности потенциалов между электродами. Очевидно, что при использовании такой модификации пипетку заполняют раствором, имитирующим внеклеточную среду, тогда как омывающий раствор делают близким по составу к цитоплазме. При этом, меняя состав омывающего раствора, можно изучать, как такие изменения в цитоплазме влияют на ток интересующих нас каналов — ведь омывающий раствор контактирует с цитоплазматической стороной мембраны). При этом мы точно знаем как состав жидкости по обе стороны мембраны, так и разности потенциалов, что позволяет достаточно точно характеризовать каналы, используя биофизические уравнения Нернста и Гольдмана-Ходжкина-Каца. При этом, если в изолированный участок мембраны попал один канал, то мы наблюдаем поведение единичной молекулы и, если это лиганд-регулируемый канал-рецептор, то её взаимодействие с другими единичными молекулами.
Конфигурация Whole-cell
Если по условиям эксперимента необходимо менять состав внеклеточной среды, можно использовать конфигурацию whole cell. В этом случае пипетку не отводят от клетки, а подают в неё отрицательное давление и таким образом разрушают изолированный фрагмент мембраны.
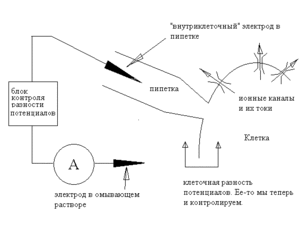
После этого пипетка соединена с внутриклеточной средой; поскольку клетка обычно маленькая, то, благодаря диффузии, состав цитоплазмы вскоре оказывается идентичным составу пипеточного раствора, поэтому мы, как и в предыдущем случае, знаем как состав жидкостей, так и разность потенциалов. Отметим, что если в конфигурации inside-out пипеточный электрод был «внеклеточным», а внутренний — «внутриклеточным», то теперь они поменялись ролями. С точки зрения изучения тока через каналы, преимущество этого метода состоит в том, что здесь оказываются сохранны клеточные структуры и регуляторные механизмы. Правда, низкосолекулярные вещества могут диффундировать из цитоплазмы в пипетку и наоборот, так что полной сохранности регуляторных механизмов в данной конфигурации достичь не удается. Определенным недостатком конфигурации можно считать то, что измеряется суммарный ток всех каналов в клетке, а не токи через одиночные каналы, то есть разрешающая способность этого метода ниже, чем у конфигураций с оторванной мембраной.
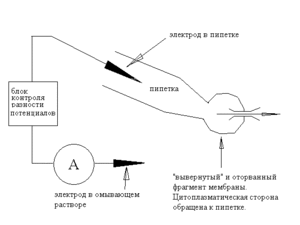
Конфигурация Outside-out
Решить проблему сниженной разрешающей способности метода позволяет конфигурация outside-out. Если после перехода в whole-cell mode медленно отводить пипетку от клетки, мембрана не отрывается сразу, а начинает вытягиваться в трубку — это видно на фото 5.

Обратите внимание — в пипетке отчетливо видны кусочки цитоплазмы, попавшие туда после разрушения мембраны при переходе в whole-cell.
Следующая фаза процесса представлена на фото 6.

Мембранная трубка стала совсем тонкой и почти невидима. В следующее мгновение трубка порвётся, а мембрана сомкнется на пипетке в «вывернутом» виде — мы окажемся в конфигурации «outside-out»
Итак, пипетка и ее электрод — подобно конфигурации whole-cell — внутриклеточные, мы свободно меняем состав внеклеточного раствора, площадь исследуемой мембраны невелика, так что мы вновь можем изучать одиночные каналы.
Perforated patch
Perforated patch— это специфический вариант patch-clamp в whole-cell mode. В данном случае, в пипеточном растворе содержится небольшое количество специального антибиотика, например, амфотерицина-В либо грамицидина. Антибиотики этого класса формируют ионные каналы в клеточной мембране на участке, присоединённом к микропипетке.
Такой подход позволяет избежать замещения внутренней среды клетки раствором из пипетки-электрода, то есть клетка остаётся живой с минимальными, насколько это возможно, повреждениями. Таким образом, ответы клетки на раздражители являются максимально приближёнными к естественным. В то же время, данному методу присущ ряд недостатков. Во-первых, по сравнению с классическим whole-cell mode, входное электрическое сопротивление является значительно более высоким. Это понижает качество фиксации потенциала, повышает уровень шума при записи, и увеличивает значения всех ошибок, связанных с изменениями сопротивления полной цепи. Во-вторых, для того, чтобы антибиотик подействовал, требуется довольно много времени, что существенно уменьшает полезный период эксперимента. И, в-третьих, антибиотик повреждает мембрану также и в месте соединения с кончиком пипетки, что приводит к ускоренному разрушению гигаомного контакта и дополнительно уменьшает эффективное экспериментальное время. Таким образом, данный вариант метода может быть с успехом использован только в экспериментах, которые не требуют продолжительного времени для изучения исследуемых явлений.
Nucleated patch
Интересная разновидность patch-clamp — nucleated patch..
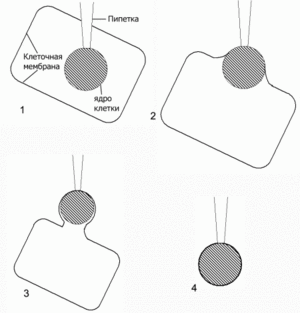
Метод состоит в следующем. Пипетка подводится к клетке, а затем рывком пробивает мембрану. После этого кончик пипетки подводится к клеточному ядру, на пипетку подается небольшое отрицательное давление. В результате пипетка присасывается к ядру. Затем пипетка с ядром на конце плавно отводится назад и вынимается из клетки. Пипетку необходимо вывести из клетки таким образом, чтобы участок мембраны в месте выхода «наделся» на присосавшееся ядро и оторвался, обернувшись вокруг него. В результате получается специфический вариант outside-out patch, при котором гораздо больший, чем в обычном варианте метода, участок мембраны присоединён к концу пипетки, будучи обёрнутым вокруг клеточного ядра.
Фиксация потенциала и фиксация тока
Когда изучаются изменения проводимости однотипных каналов в ответ на какие-то химические воздействия или зависимость их проводимости от разности потенциалов на мембране, удобно фиксировать потенциал и измерять ток канала — как мы до сих пор и описывали. Этот, самый частый вариант patch-clamp, называется voltage clamp. Однако, иногда исследователя интересуют процессы трансмембранного переноса ионов, связанные с изменением мембранного потенциала — например, проведение нервного импульса. В таких случаях можно поступить противоположным образом: зафиксировать на постоянном уровне ток, и изучать изменения разности потенциалов при этом. Такой вариант называется current clamp.
Просмотров: 16082
|
|
