Биология - Зимография
08 февраля 2011электрофоретическая технология, основанная на SDS-PAGE, которая включает субстратную сополимеризацию с полиакриламидным гелем, для обнаружения ферментативной активности. Образцы готовят в стандартно обработанном SDS-PAGE буфере, но без кипячения и без редуцирующего агента. После электрофореза, SDS удаляется из геля выдерживанием в небуферезированном Тритон X-100, затем следует выдерживание в подходящем расщепляющем буфере, за оптимальный отрезок времени при 37 °C. Далее, зимограмма окрашивается, при этом, в том месте, где субстрат был расщеплён ферментом, проявляются области расщепления в виде отчётливых полосок на тёмно окрашенном фоне. Эти протоколы, однако, нуждаются в сильных уточнениях. Например, пищеварительная гликозидаза D. melanogaster выживает в редуцированных условиях и при объёмном подогреве.
Действительно, разделение дальнейшим нагреванием до 50 °C приводит к явному увеличению разрешения полос, без существенных потерь активностей.
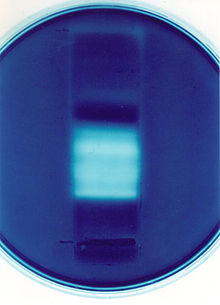
Желатин — это наиболее стандартный из используемых субстратов и может быть полезен для демонстрации активности желатин разрушающих протеаз, но зимография может быть применена и к широкому кругу ферментов, включающему ксилоназы, протеазы, липазы, хитаназы, и т. д.
Общий протокол, используемый в прошлом для зимографии альфа-амилазной активностей, был назван протоколом тонкого слоя крахмала W. W. Doane. По этому протоколу исходный PAGE гель запускался для разделения белков в гомогенате. После этого тонкий гель с с растворённым в нём крахмалом покрывался сверху исходным гелем на некоторое время. Крахмал окрашивался раствором Люголя.
Обратная зимография сополимеризует как субстрат, так и фермент с акриламидом, и это полезно для демонстрации активности ингибитора фермента. При последующем окрашивании, участки ингибирования визуализируются как тёмные пятна на чистом.
Просмотров: 8370
|
|
