Биология - Апоптоз - Регуляция апоптоза
09 февраля 2011Оглавление:
1. Апоптоз
2. История исследования
3. Происхождение и эволюция апоптоза
4. Фазы апоптоза
5. Регуляция апоптоза
6. Роль апоптоза в многоклеточном организме
7. Патология, обусловленная нарушениями апоптоза
8. Другие формы гибели клетки
Семейство белков Bcl-2
В семействе Bcl-2 различают проапоптозные и антиапоптозные белки. К группе ингибиторов апоптоза принадлежат: Bcl-2, Bcl-xL, Bcl-w, Md-1, A-1, Boo и др. К противоположной группе промоторов апоптоза относят белки подсемейства Bax и BH3: Вах, Bad, Bok, Bcl-xS, Bak, Bid, Bik, Bim, Krk, Mtd и др. Предполагается, что для регуляции ответа клетки на сигналы смерти, имеет значение соотношение про- и антиапоптозных белков. При этом регуляция апоптоза белками семейства Bcl-2 осуществляется преимущественно на отрезке митохондриального сигнального пути, так как сигналы от рецепторов смерти в основном обходят контроль со стороны Bcl-2.
Белки семейства Bcl-2 контролируют апоптоз, как минимум, двумя путями. Во-первых, белки Bcl-2, Bcl-xL и Bax могут формировать ионные каналы, либо участвовать в их формировании. К примеру, Bcl-2 прямо или косвенно предотвращает высвобождение из митохондрий цитохрома c. В противоположность этому Bax в комплексе с порином образует во внешней мембране митохондрий канал, по которому в цитоплазму высвобождаются цитохром с и AIF. Помимо каналообразующей активности белки семейства Bcl-2 могут выступать в роли адаптеров связывающихся с белками, участвующими в процессе апоптоза. Например, Bcl-xL может ингибировать соединение Apaf-1 с прокаспазой-9, предотвращая активацию каспазы-9.
Ингибиторы белков апоптоза
Ингибиторы белков апоптоза впервые были обнаружены у бакуловирусов. Вслед за этим открытием гомологи IAP были выявлены у всех эукариот, от дрожжей до млекопитающих. В структуре IAP выделяют от одного до трёх 70-аминокислотных N-концевых BIR-доменов. К тому же X-хромосомный XIAP и клеточный cIAP1,2 содержат С-концевой RING-домен.
Основная роль ингибиторов белков апоптоза заключается в подавлении функционирования каспаз −3, −7, −9. При этом BIR-домены связывают активные сайты каспаз, а RING-домены участвуют в деградации каспаз за счёт убиктивин-лигазной активности. Действие IAP подавляется регуляторами Smac/DIABLO и Omi/HtrA2, высвобождающимися из межмембранного пространства митохондрий. Помимо этого каспазы −3 и −7 при сверхэкспрессии способны самостоятельно расщеплять XIAP.
FLIP — внутриклеточный ингибитор каспазы-8, блокирующий передачу сигнала апоптоза через рецепторы смерти. Роль FLIP является противоречивой, так как его сверхэкспрессия или ингибирует, или активирует апоптоз.
Альтернативные пути передачи сигнала от рецепторов смерти
Активация рецепторов смерти TNFR1 или DR3 ведёт к равновероятному запуску двух альтернативных путей, один из которых оканчивается апоптозом, а другой препятствует индукции апоптоза. Дело в том, что адаптер TRADD, связанный с рецепторами TNFR1 и DR3, наряду с активацией прокаспазы-8, участвует в активации ядерных факторов транскрипции NF-kB и JNK/AP-1. Факторы NF-kB и JNK/AP-1 в свою очередь контролируют синтез белковых регуляторов, которые блокируют TNF- или Apo3L-индуцированную активацию каспазы-8, вследствие чего подавляется опосредованный рецепторами апоптоз.
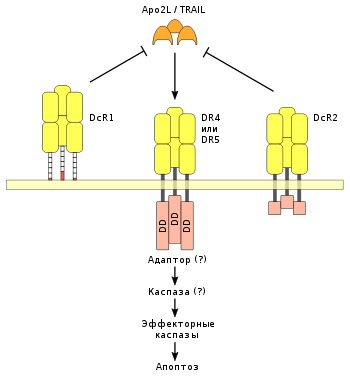
Дополнительными регулятороами в рецептор-зависимом сигнальном пути апоптоза являются «обманные» DcR-рецепторы, которые конкурируют с DR4 и DR5 в связывании лиганда Apo2L. DcR1-рецептор — клеточный поверхностный белок, у которого отсутствует цитоплазматический хвост. DcR2 — рецептор со значительно укороченным цитоплазматическим доменом смерти. Оба рецептора, DcR1 и DcR2, благодаря структурному сходству с DR4 и DR5, подавляют активацию апоптоза лигандом Apo2L.
Белок p53
В нормальных клетках белок p53, как правило, находится в неактивной, латентной форме. Активация p53 происходит в ответ на повреждения ДНК, вызванные ультрафиолетовым или гамма-излучением, гиперэкспрессий онкогенов, вирусной инфекцией, оксидативным стрессом, гипо- и гипертермией и др. Активированный p53 координирует процесс репарации ДНК, а также регулирует транскрипцию ряда генов-активаторов апоптоза в случае необратимых повреждений ДНК или нарушений регуляции клеточного цикла. К тому же имеются указания на то, что p53 принимает участие в запуске апоптоза путём стимуляции рецепторов смерти, путём взаимодействия с промотором апоптоза — Bax, путём активации p53-зависимого модулятора апоптоза PUMA, который блокирует действие Bcl-2. Повышение уровня p53 в ответ на повреждения ДНК вызывает апоптоз, например, в клетках кожи, в тимоцитах, в клетках кишечного эпителия.
Просмотров: 39574
|
|
