Биология - Цитоскелет прокариот - Гомологи актина
08 февраля 2011Оглавление:
1. Цитоскелет прокариот
2. Гомологи актина
3. Гомологи тубулина
В 2001 году Джонс и сотрудники обнаружили, что у бактерии Bacillus subtilis имеются белки гомологи актина, которые формируют длинные спиральные структуры. Это открытие дало начало интенсивному развитию исследований в области цитоскелета прокариот, вследствие чего было обнаружено много других гомологов актина. Для всех этих белков характерно наличие актинового АТФазного домена. Большинство из них, как и актин у эукариот, является частью цитоскелета, однако некоторые имеют другие функции, например FtsA, которые принимает участие в клеточном делении, шаперон DnaK и гексокиназе. Гомологи актина бактерий имеют схожее пространственное строение, но преимущественно достаточно сильно отличаются по аминокислотной последовательности. Также эти белки имеют отличительные характеристики динамики полимеризации и свойств филаментов, которые они образуют. Очевидно, что в отличие от эукариот, которые используют один и тот же актин для очень разных потребностей клетки, бактерии имеют много вариантов схожих белков, каждый из которых специализирован на использовании отдельной функции.
Пространственное строение эукароитического актина и его прокариотических гомологов MreB и ParM, все белки находятся в АДФ-связанной форме
-
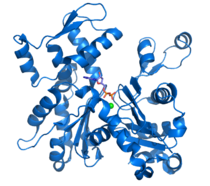
Эукариотический белок цитоскелета тубулин
-
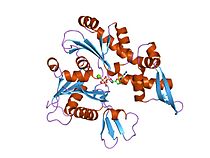
Прокариотический белок цитоскелета MreB
-
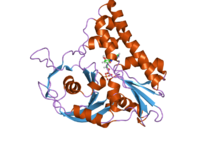
Белок, который принимает участие в расхождении плазмид у бактерий ParM
MreB и его гомологи
MreB и его гомологи — белки распространены среди бактреий, имеющих палочкоподобную или спиральную формы, и отсутствует у кокков. Некоторые бактерии, например, Escherichia coli и Caulobacter crescentus, содержат только ген белка MreB, тогда как другие, в частности, Bacillus subtilis, кроме него имеют также гены его гомологов Mbl и MreBH. Эти белки обеспечивают поддержание палочкоподобной формы клетки, её полярности, а также расхождение копий бактериальной ДНК во время деления.
Структура и динамика филаментов MreB и его гомологов
In vivo белок MreB и его гомологи образуют длинные спиральные филаменты, расположенные вдоль бактериальной клетки, они могут объединяться в прочные и достаточно гибкие пучки. Такие филаменты являются динамическими структурами, продолжительность их полужизни обычно не превышает нескольких минут. Кроме того, у некоторых видов, в частности, C.crescentus и Rhodobacter sphaeroides филаменты MreB изменяют своё расположение в течении клеточного цикла: во время деления они концентрируются в центральной части клетки и образуют кольцо. Однако, поскольку мутанты с делецией гена mreB не утрачивают способность к цитокинезу, очевидно белок MreB не является необходимым для этого процесса.
Как было показано в экспериментах на белках бактерии Thermotoga maritima мономерные единицы MreB способны к самоорганизации in vitro в длинные линейные филаменты, которые состоят из двух протофиламентов, расположенных параллельно. По строению филаменты MreB отличаются F-актина, образованного двумя цепями спирально закрученными один вокруг другого. Для полимеризации MreB необходимо наличие в среде АТФ, однако она происходит одинаково успешно и в присутствии ГТФ. Это связано с тем, что новые субъединицы включаются в состав полимера только в форме, связанной с нуклеотидтрифосфатом, позднее происходит гидролиз связанного АТФ или ГТФ до АДФ или ГДФ соответственно.
Функции MreB и его гомологов
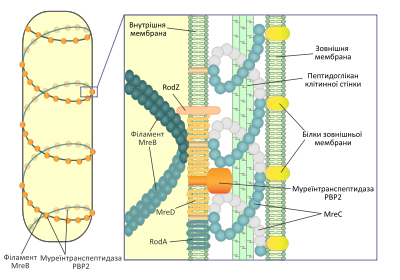
Одной из основных функций филаментов MreB и гомологических белков является поддержание палочкоподобной или спиральной формы бактериальной клетки. Мутации, которые нарушают экспрессию этих белков, приводят к выраженному изменению формы бактерий. Однако филаменты MreB не служат непосредственно каркасом для поддержания формы клетки, вместо этого, располагаясь по спирали вдоль неё, они являются сайтами для прикрепления ферментов, синтезирующих пептидогликан клеточной стенки. Таким образом они регулируют характер отложение новых элементов на оболочку бактерий, которая собственно и является определяющим фактором в поддержании постоянной формы. Подобным образом микротрубочки растительной клетки влияют на её форму, направляя включения молекул целюлозы в клеточную стенку. У многих бактерий ген mreB является частью оперона, в состав которого входят также гены mreC и mreD. Этот оперон входит в большой кластер генов, необходимых для биосинтеза пептидогликана. Продукты генов mreC и mreD — это белки внутренней мембраны грамотрицательных бактерий, они взаимодействуют с белком MreB и принимают участие в организации его комплекса с ферментами, задействованными в биосинтезе муреина, такими как муреинтранспептидаза PBP2. Также в состав этого комплекса входят трансмембранные белки RodZ и RodA.
Филаменты MreB также принимают участие в определении некоторых аспектов полярности клетки, в частности концентрации на одном или обоих полюсах некоторых белков, например, тех, что отвечают за хемотаксис, подвижность, секрецию и вирулентность.
Ещё одной функцией MreB и его гомологов является участие в расхождении копий бактериальной хромосомы во время деления. Среди мутантов, у которых этот белок отсутствует, были обнаружены клетки с несколькими нуклеоидами в цитоплазме, а также и клетки, не имевшие хромосом. Местом прикрепления белков MreB к бактериальной ДНК является точка oriC, присоединение происходит или непосредственно, или при участии других белков. Во время деления филаменты цитоскелета обеспечивают расхождение точек oriC двух копий ДНК к противоположным концам клетки, механизм этого процесса пока не выяснен. Также неизвестно каким образом происходит расхождение хромосом у кокков, у которых отсутствует ген mreB и его гомологи.
Белок разделения плазмид ParM
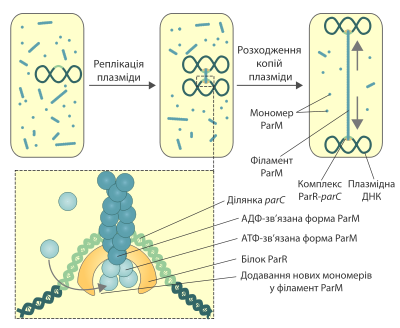
Много малокопийных плазмид бактерий имеют специальные системы, обеспечивающие их расхождение после репликации. Эти механизмы необходимы для того, чтобы после деления каждая из дочерних клеток получила по крайней мере одну молекулу плазмидной ДНК. Известно три типа систем, обеспечивающих расхождение малокопийных плазмид, в каждой из которых используются разные моторные белки. Один из этих белков — ParM — является гомологом эукариотического актина. Впервые он был обнаружен при исследовании пламзиды R1 E.coli. Сейчас эта система сегрегации плазмидной ДНК является лучше всего изученной. Схожая система была обнаружена и и в других плазмидах, в частности, тех, что отвечают за распространение устойчивости ко множеству препаратов.
Структура и динамика филаментов ParM
Как и все элементы цитоскелета, филаменты ParM состоят из мономерных белковых субъединиц. Эти субъединицы способны к полимеризации in vitro в присутствии АТФ или ГТФ. Образованные нитки состоят из двух протофиламентов, закрученных один вокруг другого. В живых клетках мономеры ParM формируют длинные неразветвлённые филаменты, которые размещаются вдоль оси бактерии. В отличии от актина и MreB и его аналогов, ParM не образует пучков.
Полимеризация и диссоциация мономеров ParM зависит от присоединения и гидролиза АТФ. Новые субъединицы включаются в состав филамента в АТФ-связанной форме, причём присоединение может происходить на обоих концах филамента. Одновременно со включением новой ParM-АТФ субъединицы происходит гидролиз АТФ в последней присоединённой белковой молекуле. Таким образом, весь филамент состоит из белков ParM-АДФ, и только на концах находятся ParM-АТФ субъединицы, которые «кепуют» всю структуру, стабилизируя её.
При отсутствии соответствующей плазмиды полимеризация филаментов ParM продолжается до тех пор, пока они не достигают определённой критической длины. После этого они начинают очень быстро диссоциировать, причём скорость их этого процесса приблизительно в 100 раз превышает таковую для F-актина. Таким образом, по динамике распада эти элементы больше напоминают микротрубочки эукариот.
Принцип функционирования филаментов ParM
Ген parM входит в локус par плазмиды R1, кроме него тут также содержится участок parC, играющий роль, аналогичную центромере в хромосомах эукариот, а также ген parR, продукт которого ParR присоединяется к участку parC и осуществляет ауторегуляцию транскрипции локуса par, а также служит адаптером для присоединения белка ParM.
После репликации плазмиды R1 до обеих её копий в участке parC присоединяется белок ParR. В таком состоянии он может связывать и стабилизировать филаменты ParM, которые постоянно собираются и разбираются в цитоплазме. После этого полимерные нитки ParM начинают удлиняться, присоединяя на каждом конце новые мономеры. Этот процесс сопровождается гидролизом АТФ. Вследствие удлинения филамента две плазмиды, что присоединены к его краям, располагаются в разные стороны, пока не достигают полюсов клетки. После этого происходит диссоциация полимера ParM.
Белок организации магнетосом MamK
Ещё один прокароитический гомолог актина MamK принимает участие в организации мембран магнетосом. Магнетосомы — это органеллы бактерий родов Magnetospirillum и Magnetococcus, которые содержат кристаллы магнетита, окружённые мембраной, и помогают бактерии ориентироваться в геомагнитном поле. В клетке магнетосомы расположены в ряд, с ними всегда ассоциированы длинные филаменты белки MamK.
Просмотров: 11483
|
|
